肺部疾病与内分泌疾病之间存在密不可分的关系。临床上,肺部疾病常会伴随内分泌疾病。研究发现,高血糖患者发生肺部感染的几率相比于非高血糖患者更高,在糖尿病患者中,活动性结核病风险比非糖尿病患者高3.59倍,不仅如此,金黄色葡萄球菌,革兰氏阴性细菌以及真菌肺部感染风险也明显增加。
在一例探讨肺脓肿相关脓胸危险因素的文章中提到,合并糖尿病的患者发生肺脓肿相关脓胸的风险较非糖尿病组高出9倍。此外,对于糖尿病患者,除了肺部感染发生率升高以外,哮喘的发生率较非糖尿病患者也高出33%。
为什么说肺部疾病与内分泌疾病密切相关?
内分泌激素对许多肺部炎症具有调节作用,而肺部急慢性炎症也对内分泌激素水平同样产生影响。
并且,肺部的恶性肿瘤与内分泌系统的相互作用是多方面的。一方面,肿瘤细胞可转移到肾上腺、垂体等内分泌腺体,影响激素分泌;另一方面,肺癌可引起多种副肿瘤性内分泌综合征,有数据显示内分泌副瘤综合征在肺部肿瘤中的发生率约为10%。
肺部疾病合并内分泌疾病的筛查和诊断
一、肺部疾病患者的糖尿病筛查和诊断
肺部感染入院患者常规筛查空腹血糖和糖化血红蛋白,尤其合并肥胖、阻塞性睡眠呼吸暂停(OSA)、高血压、糖尿病家族史的患者。根据《中国2型糖尿病防治指南(2020版)》定义糖尿病的诊断标准,必要时可完善口服葡萄糖耐量试验。
二、内分泌副瘤综合征的筛查和诊断
肺部肿瘤分泌激素,从而引起一系列内分泌临床综合征,从属于副瘤综合征范畴,如图1所示。
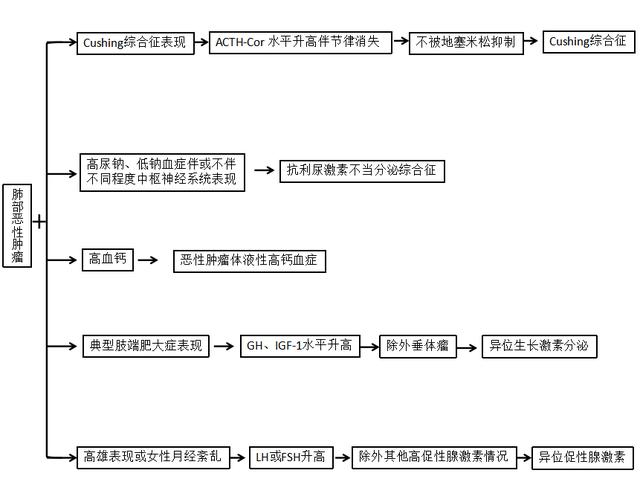
图1 内分泌副瘤综合征
注:ACTH:促肾上腺皮质激素;COR:皮质醇;GH:生长激素;IGF-1:类胰岛素一号生长因子;LH:促黄体生成;FSH:卵泡雌激素。
(一)异位Cushing综合征
是指恶性肿瘤异位分泌ACTH引起的Cushing综合征。在所有肺部肿瘤中,约30%的小细胞肺癌会出现异位ACTH分泌,主要通过ACTH-Cor水平升高且升高的ACTH-Cor不被大剂量地塞米松所抑制来鉴别诊断。
(二)抗利尿激素不当分泌综合征
10%~45%的小细胞肺癌(非小细胞肺癌仅有1%)可以异位分泌ADH(抗利尿激素)。抗利尿激素不当分泌综合征主要表现为高尿钠、低钠血症,急性严重的低钠血症还会引起脑水肿,引起精神障碍、癫痫甚至死亡,而轻中度多无明显中枢系统表现。
(三)高钙血症
在肺癌中的发生率约为8%~12%;副瘤综合征引起的高钙血症在这里被称作恶性肿瘤体液性高钙血症,是指恶性肿瘤分泌甲状旁腺相关蛋白;高钙综合征多在晚期肺癌中多见,且常预示不良预后。
(四)异位生长激素分泌
支气管类癌、鳞状细胞癌可出现异位生长激素分泌,多为典型肢端肥大症表现,有些合并糖尿病、肥胖等代谢性疾病,化验结果提示GH、IGF-1水平升高且不被高糖抑制。
(五)促性腺激素分泌
多见于肺大细胞肺癌,可分泌多种促性腺激素,如促黄体生成素(LH),卵泡雌激素(FSH),人绒毛膜促性腺激素(HCG)和催乳素(PRL)。
肺癌免疫治疗与垂体-靶腺轴的损伤
免疫检查点抑制剂(immune checkpoint inhibitors,ICPis)是目前最受瞩目的肿瘤免疫治疗药物之一,被广泛用于肺癌和其他肿瘤的治疗。ICPis通过上调免疫应答杀伤肿瘤的同时,过度活化的免疫功能也可能会导致机体的自身免疫损伤,即免疫相关不良反应(immune-related adverse events,irAEs)。
所有内分泌相关器官均有可能受累,临床上包括垂体炎、甲状腺免疫损伤、胰岛功能损伤、肾上腺皮质功能减退、原发性甲状旁腺功能减退症等。
一、ICPis相关垂体损伤
应用ICPis治疗的男性患者需关注垂体炎的发生,尤其是CTLA-4(细胞毒性T淋巴细胞相关蛋白4)抑制剂治疗及联合治疗的患者。
ICPis相关垂体炎最常引起TSH(促甲状腺激素)、ACTH、FSH、LH缺乏,GH缺乏和催乳素异常少见,垂体后叶激素缺乏极为罕见。主要为中枢性肾上腺功能不全(central adrenal insufficiency,CAI),即ACTH-皮质醇轴系全面减低,24小时尿游离皮质醇严重偏低,同时伴随乏力、食欲减低等表现,但对于肿瘤患者临床表现并不特异,因此需更加注意鉴别和动态复查。
当出现垂体炎所致肾上腺皮质功能减退症同时需要筛查甲状腺功能、性激素六项、生长激素、胰岛素样生长因子-1等,若表现为头痛时可完善垂体磁共振检查,一般影像学上可见轻至中度弥漫性垂体增大,但多在几周内消失,仅需动态观察即可,占位效应或需外科干预情况罕见。
二、ICPis相关甲状腺损伤
多数患者在接受ICPis治疗后的8~12周之内出现甲状腺功能异常,建议在此期间监测TSH和FT4(游离四碘甲状腺素),若出现甲功异常,需完善甲状腺相关抗体及甲状腺超声,明确甲状腺毒症的病因并给予相应的治疗。对于既往甲状腺疾病史的患者,建议治疗开始的第一个月起始甲状腺功能的定期监测。
三、ICPis相关胰岛功能损伤(ICPis相关糖尿病)
ICPis相关胰岛功能损伤的发病率较其他内分泌器官免疫损伤少见,且主要发生在PD-1(程序性死亡蛋白-1)抑制剂单药治疗过程中,占比71%~76%。
ICPis相关糖尿病分型未定,因病因为免疫因素介导、糖尿病酮症酸中毒的风险较高,目前多认为是1型糖尿病,但其发病年龄较大(多>60岁),因此又不同于典型的1型糖尿病。
四、ICPis相关肾上腺皮质功能减退(primary adrenal insufficiency,PAI)
严重者可发生肾上腺危象。根据ICPis用药史、临床表现、血皮质醇和ACTH水平可诊断,必要时行ACTH兴奋试验与中枢性肾上腺皮质功能减退鉴别;病因诊断需完善肾上腺CT检查、抗21-羟化酶抗体加以鉴别。
五、ICPis相关甲状旁腺功能减退症
仅数例病例报道了使用PD-1过程中出现低钙血症、低甲状旁腺激素水平;其中仅一例为患纳武利尤单抗治疗小细胞肺癌(small cell lung cancer,SCLC)数月后,出现恶心、呕吐、上腹疼痛、便秘、乏力住院查出甲状旁腺功能减退症;另外两例为晚期黑色素瘤,其一为伊匹单抗联合尼鲁单抗;另一例为纳武利尤单抗联合伊匹单抗。
采用ICPis药物联合治疗明显增加内分泌免疫损伤的发生。《免疫检查点抑制剂引起的内分泌系统免疫相关不良反应专家共识(2020) 》推荐使用此类药物时需根据临床表现及相关化验结果,警惕ICPis相关内分泌损伤,并定期复查;可疑此类药物引起的内分泌免疫损伤需请内分泌科医师会诊,同时制定患者综合情况评分,根据疾病轻重决定是否需停药ICPis药物以及是否需紧急干预,或是常规处理,并指导定期复查及调药。

参考文献:
[1] Al-Rifai RH, Pearson F, Critchley JA. Association between diabetes mellitus and active tuberculosis: A systematic review and meta-analysis. PLoS ONE. 2017;12:e0187967.
[2] CAI X D,YANG Y,LI J Z,et al. Logistic regression analysis of clinical and computed tomography features of pulmonary abscesses and risk factors for pulmonary abscess related empyema[J]. Clinics, 2019, 74:e700.
[3] Tianshi David Wu, Emily P. Brigham, Corinne A. Keet,et al. Association Between Prediabetes/Diabetes and Asthma Exacerbations in a Claims-Based Obese Asthma Cohort[J]. The Journal of Allergy and Clinical Immunology: In Practice,Volume 7, Issue 6, 2019, 1868-1873.e5.
[4] Heinemann S, Zabel P, Hauber HP. Paraneoplastic syndromes in lung cancer[J]. Cancer Ther, 2008, 6: 687-698.
[5] Gewirtz G, Yalow RS. Ectopic ACTH production in carcinoma of the lung. J Clin Invest. 1974 Apr; 53(4): 1022-32.
[6] Kagawa K, Fujitaka K, Isobe T, et al. Syndrome of inappropriate secretion of ADH (SIADH) following cisplatin administration in a pulmonary adenocarcinoma patient with a malignant pleural effusion[J]. Intern Med, 2001, 40: 1020-1023.
[7] Moses AM, Scheinman SJ. Ectopic secretion of neurohypophyseal peptides in patients with malignancy[J]. Endocrinol Metab Clin North Am, 1991, 20: 489-506.
[8] Spiro SG, Gould MK, Colice GL. Initial evaluation of the patient with lung cancer: symptoms, signs, laboratory tests, and paraneoplastic syndromes: aCCP evidenced-based clinical practice guidelines (2nd edition)[J]. Chest, 2007, 132:149S-60S.
[9]Hiraki A, Ueoka H, Takata I, et al. Hypercalcemia-leukocytosis syndrome associated with lung cancer[J]. Lung Cancer, 2004, 43: 301-307.
[10] Wright J J, Salem J E, Johnson D B, et al. Increased reporting of immune checkpoint inhibitor–associated diabetes[J]. Diabetes Care, 2018, 41(12): e150-e151.
[11] de Filette J M K, Pen J J, Decoster L, et al. Immune checkpoint inhibitors and type 1 diabetes mellitus: a case report and systematic review[J]. European journal of endocrinology, 2019, 181(3): 363-374.
[12] Clotman K, Janssens K, Specenier P, et al. Programmed cell death-1 inhibitor–induced type 1 diabetes mellitus[J]. The Journal of Clinical Endocrinology & Metabolism, 2018, 103(9): 3144-3154.
[13] Dadu R, Rodgers TE, Trinh VA, et al. Calcium-sensing receptor autoantibody-mediated hypoparathyroidism associated with immune checkpoint inhibitor therapy: diagnosis and long-term follow-up. J Immunother Cancer. 2020 Jun;8(1): e000687.
[14] Trinh B, Sanchez G O, Herzig P, et al. Inflammation-induced hypoparathyroidism triggered by combination immune checkpoint blockade for melanoma[J]. Journal for immunotherapy of cancer, 2019, 7(1): 1-5.
[15] Win MA, Thein KZ, Qdaisat A, Yeung SJ. Acute symptomatic hypocalcemia from immune checkpoint therapy-induced hypoparathyroidism[J]. Am J Emerg Med, 2017, 35(7): 1039 e5–7.
[16]Chang L S, Barroso-Sousa R, Tolaney S M, et al. Endocrine toxicity of cancer immunotherapy targeting immune checkpoints[J]. Endocrine reviews, 2019, 40(1): 17-65.
[17] 免疫检查点抑制剂引起的内分泌系统免疫相关不良反应专家共识(2020) [J]. 中华内分泌代谢杂志, 2021, 37(01) : 1-16.
好了,这篇文章的内容发货联盟就和大家分享到这里,如果大家网络推广引流创业感兴趣,可以添加微信:80709525 备注:发货联盟引流学习; 我拉你进直播课程学习群,每周135晚上都是有实战干货的推广引流技术课程免费分享!